試卷測驗 - 112 年 - 112-1 國立嘉義女子高級中學教師甄選初試:化學科#115083-阿摩線上測驗
lost剛剛做了阿摩測驗,考了17分
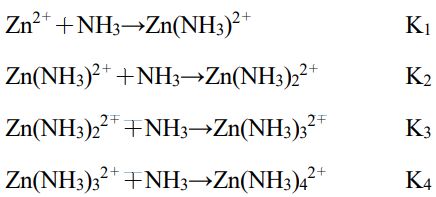
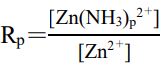 。Log(Rp)與 log([NH3])呈現出如下圖所示的線性
關係。根據所述,回答下列問題:
。Log(Rp)與 log([NH3])呈現出如下圖所示的線性
關係。根據所述,回答下列問題: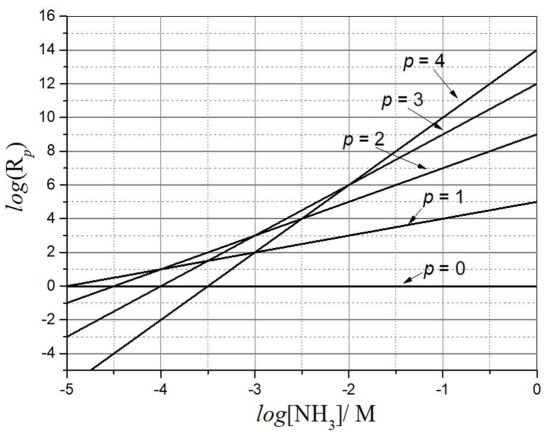
3. 下列各組中,何組分子的形狀皆相同?
(A)IF3,SO32-
(B)NF3,BF3
(C)OF2,N2O
(D)[NiCl4]2-,[Ag(NH3)2]
+
(E)BeH2,HCN。
7. 用強鹼滴定莫耳數比為1:1之H3PO4和NaH2PO4溶液。下列滴定曲線,何者正確?
(縱軸為pH值,橫軸為滴定體積)(H3PO4:pKa1=2.1,pKa2=7.2,pKa3=12.0)
(A) 
(B) 
(C) 
(D) 
(E) 
11. 附有活塞的容器先裝液體CS2(l)、CS2(g)及飽和的空氣,於1atm、7℃時的狀態如附圖所示,壓力維持1atm不變,溫度
上升至27℃,則活塞應移至哪一個刻度?(取近似值,且CS2的飽和蒸氣壓在7℃時為180mmHg、27℃時為400mmHg,混合氣體視為理想氣體,由於膨脹與蒸發所引起的液面升降、活塞的重量及摩擦力均可忽略)

(A)3.2
(B)3.7
(C)5.2
(D)5.5
(E)6.5。
12. 定溫時,壓力分別為P1、P2條件下,A(g)+2B(g)⇌ nC(g)反應系中,C的莫耳含量與時間t的曲線如附圖。則下列何項正確?

(A)P1>P2,n<3
(B)P1<P2,n>3
(C)P1<P2,n=3
(D)P1>P2,n>3
(E)P1=P2,n=3。
32. 在一個未知的星球上,溫度與地球相似,已知其地表岩石的主要成分為碳酸鈣,大氣中存在0.1atm的二氧化碳與其
他鈍性氣體,星球上的河流充滿飽和溶解的碳酸鈣,科學家測得河水非常接近中性,[H+]=1.8×10-7M,如果已知
有下列化學反應: 請問河水中鈣離子的含量為__(6)__ ppm。(四捨五入到小數點下第一位)
請問河水中鈣離子的含量為__(6)__ ppm。(四捨五入到小數點下第一位)
35. 合成分子量在2000~50000範圍內,具有確定結構的有機化合物是一個新研究領域。1993年報導合成了兩種烴A和B
,其分子式分別為C1134H1146和C1398H1278。B的結構跟A相似,但分子中多了一些 的結構單元,則B分
子比A分子多了__(9)__個這樣的結構單元。
的結構單元,則B分
子比A分子多了__(9)__個這樣的結構單元。