試卷測驗 - 113 年 - 113-1 國立中央大學附屬中壢高級中學_教師甄選試題:化學科#119588-阿摩線上測驗
YJ剛剛做了阿摩測驗,考了28分
7. 今有四個半電池(其離子濃度為 1M,H2 的壓力為 1atm)A、B、C、D;A、B 組成一個電池,C、D 組成另一個
電池,再將 A、B、C、D 分別連接組成雙電池,下列哪一組合可產生最小電位差? 
(A) A=Zn│Zn2+,B=H2│H+,C=Cu│Cu2+,D=Co│Co2+
(B) A=Zn│Zn2+,B=Cu│Cu2+,C=H2│H+,D=Co│Co2+
(C) A=Zn│Zn2+,B=Co│Co2+,C=H2│H+,D=Cu│Cu2+
(D) A=Zn│Zn2+,B=H2│H+,C=Co│Co2+,D=Cu│Cu2+
8. 溶液中含有相同莫耳數的 CN-及 CH3COO-,逐滴加入濃過氯酸溶液於此溶液中,直到[H+
]
為 1.0 ✖ 10-4 M,下列敘述何者正確?(HCN 之 Ka=4.0 ✖ 10-10,CH3COOH 之 Ka=2.0 ✖ 10-5)
(A)[CH3COOH]>[HCN]
(B)[CH3COO-
]=[CN-
]
(C)[CH3COO-
]<[CN-
]
(D)

(E)
 。
。
14. 如附圖所示之實驗裝置,小明欲以鋅銀電池在銅片上鍍鎳,則下列敘述哪些正確? 
(A)導線連接:鋅棒接鎳片;銀棒接銅片
(B)反應時銀、銅片為陰極,鋅、鎳片為陽極
(C)左圖之電池反應後,整個裝置中之陽離子總數將增加
(D)銅片鍍上 0.05 莫耳鎳,需以平均 10 安培之電流電鍍 965 秒
(E)電鍍完畢後,三槽內的溶液顏色均發生變化。
16.  的平衡系在 27°C 、1 atm 下測混合氣體的密度為 2.805(g/L),下列各項敘述哪些正確?
的平衡系在 27°C 、1 atm 下測混合氣體的密度為 2.805(g/L),下列各項敘述哪些正確?
(A)此平衡系最初是放入 N2O4 達成平衡
(B)平衡時的濃度[N2O4]>[NO2]
(C)平衡時[NO2]=0.5 atm
(D) N2O4 解離度為 50 %
(E)平衡時[N2O4]:[NO2]=1:2。
19. 某原子最後一個電子的四個量子數為 n=3、ℓ=1、mℓ= -1、ms=+  ,若 ml和 ms均由正而負依序填入,關於
此原子的敘述,下列哪些正確?
,若 ml和 ms均由正而負依序填入,關於
此原子的敘述,下列哪些正確?
(A)該原子為金屬
(B)該原子和 V 有相同數量的不成對電子
(C)該原子的氫化物鍵角比 H2O 小
(D)該原子形成的元素為共價網狀固體
(E)取 1 莫耳該原子氧化數最大的含氧酸,放入 1M 2L 的 NaOH(aq)中,溶液最後呈鹼性。
20. 下列有關零級反應:A(g) → B(g)以及一級反應:C(g) → D(g)的敘述,哪些正確?
(A)反應 A(g) → B(g)的半生期隨[A]減少而變短
(B)將反應過程中[C]對時間作圖,可得下圖 
(C)將反應過程中 A 消耗的速率對[A]作圖,可得下圖: 
(D)[C]越大,半生期越長
(E)經過一個半生期後,[A]減半
)
(2)下表之各溶液依比例混合反應,何者將呈現深藍色?(2 分)

(A)
(B)
(C)
(D)
(E)
25. 已知 4HBr(g) + O2(g) →2H2O(g) + 2Br2(g),反應速率定律式為 R = kPHBr.PO2 ,於 800 K 時,將 4 升 3 atm
的 HBr 與 2 升 2 atm 的 O2 中間以細管(體積忽略不計)相接,打開活塞使其發生反應,測得反應速率為 R1 = S。
經過一段時間,當 O2 的壓力變為 atm 時,其反應速率 R2 為何?(2 分)
atm 時,其反應速率 R2 為何?(2 分)
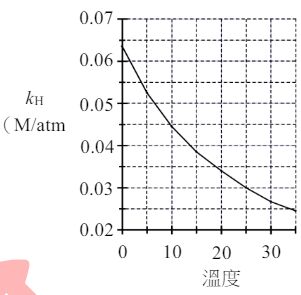
29. 碳酸飲料(如汽水)的製備是利用亨利定律的原理,將二氧化碳壓入裝有含糖調味料飲用水的玻璃瓶中後,
再加以密封。依據亨利定律,氣體在溶劑中的溶解度(
S
)與液面上該氣體的分壓(
p
)成正比,其比例
常數稱為亨利定律常數( kH ),關係式可表示如下:
S= kH✖p
式中的
S
與
p
的單位分別為體積莫耳濃度(M)與大氣壓力(atm),而
CO2
的 kH 與溫度的關係如右圖所示。
CO2 (g) 溶入水中生成
CO2 (aq) 後,小部分溶入水中的
CO2 (aq) 會與水反應形成
H2CO3(aq) ,在 25℃時,其平衡反應式與平衡常數如下:
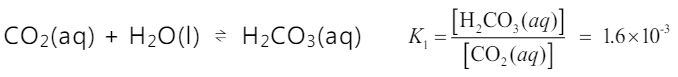 而
H2CO3 (aq) 在水中會解離成
H+(aq) 與
HCO3-(aq),其平衡反應式與平衡常數如下:
而
H2CO3 (aq) 在水中會解離成
H+(aq) 與
HCO3-(aq),其平衡反應式與平衡常數如下:
H2CO3(aq) ⇌ H + (aq) + HCO3- (aq) Ka=2.5✖10-4
今有一未開罐的汽水瓶,於 25℃時,瓶內上方的 CO2 (g) 壓力為 2.5 大氣壓,若其性質遵守亨利定律,求 出下列數值。
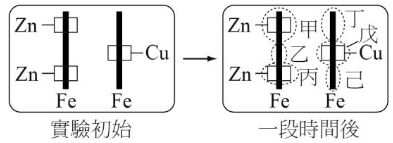
33. 小明設計以下實驗來觀察鐵生鏽。實驗初始時,將左鐵棒的上、下兩端各連上一鋅片,而在右鐵棒中段連上一銅
片(如實驗初始圖),將此二者靜置於含有 K3[Fe(CN)6](aq)及酚酞的混合膠質溶液中。經一段時間後,發現圖中
的甲、乙、丙、丁、戊、己等六區均有變化,請回答下列問題: