7.下列何者是電化學電池的電位差計算公式?
(A)Ecell = E0 – log[(Ecathode + Eanode)/2]
(B)Ecell = E0 + log[(Ecathode + Eanode)/Eanode]
(C)Ecell = Eanode – Ecathode
(D)Ecell = Ecathode – Eanode
答案:登入後查看
統計: A(486), B(458), C(889), D(2038), E(0) #3198825
統計: A(486), B(458), C(889), D(2038), E(0) #3198825
詳解 (共 5 筆)
#6276572
第一次寫詳解,有錯請告知謝謝~
ㅤㅤ
背單字時間
cation陽離子(帶正電)
anion陰離子(帶負電)
cathode正極/陰極(還原)
anode負極/陽極(氧化)
ㅤㅤ
國中理化複習
氧化(得氧失氫失電子)
還原(失氧得氫得電子)
電池的電子e-由「負極」流向「正極」
負極=失e-=氧化=陽極anode
正極=得e-=還原=陰極catode
ㅤㅤ
舉例國中學的鋅銅電池:
還記得結論是鋅棒越來越細,銅棒越來越重嗎(鍍上一層銅,因為銅還原)......
ㅤㅤ
負極鋅的半反應式:Zn → Zn2+ + 2e-失e-=氧化=陽極
➡️標準電極電位E0= (-0.76V)
➡️還原電位<0(-0.76V)、氧化電位>0(+0.76V)
國中老師都說負心(鋅)漢...
正極銅的半反應式:Cu 2+ + 2e- → Cu得e-=還原=陰極
➡️標準電極電位E0= (+0.34V)
➡️還原電位>0(+0.34V)、氧化電位<0(-0.34V)
ㅤㅤ
補充一個熱知識:標準電極電位E0=還原電位
當E0>0時,傾向還原反應;當E0<0時,傾向氧化反應
ㅤㅤ
電位差Ecell=(+1.10V)
比一般家用電池(1.5V)還小,沒錯電位差就是電壓!
電位差一定是正的!
電位差一定是正的!
電位差一定是正的!
反正就是比較兩個數字,相加相減是+1.10V就對了(下面那三行不要背!)
=陽極氧化電位-陰極氧化電位=(+0.76V)-(-0.34V)=(+1.10V)
=陽極氧化電位+陰極還原電位=(+0.76V)+(+0.34V)=(+1.10V)
=陰極還原電位-陽極還原電位=(+0.34V)-(-0.76V)=(+1.10V)
ㅤㅤ
速解:看到cat就是「+、正、>0」;an就是「-、負、<0」
不要用陰陽去記...一定會亂掉==
| -ion離子 | -ode電極 | |
| cat- | cation 帶「+」電、(陽離子) |
cathode 「正」極、(陰極還原)、E0(>0) |
| an- | anion 帶「-」電、(陰離子) |
anode 「負」極、(陽極氧化)、E0(<0) |
ㅤㅤ
回到題目
AB刪掉
CD電位差一定是正的! 找「正的」減「負的」
選(D) Ecell=Ecathode-Eanode
得酚~
62
0
#6166668
陽極(anode):發生氧化反應的電極
陰極(cathode):發生還原反應的電極
ㅤㅤ
正極:得電子的極
負極:丟電子的極
ㅤㅤ
所以在化學電池中,陽極氧化丟電子為負極,陰極還原得電子為正極
電位差是由高電位減低電位,如圖,所以是陰極(cathode)減陽極(anode)
ㅤㅤ
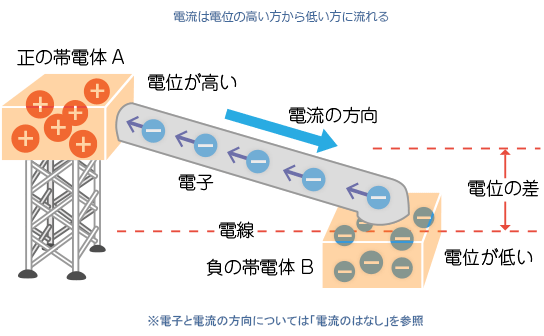
ㅤㅤ
ㅤㅤ
22
0