題組內容
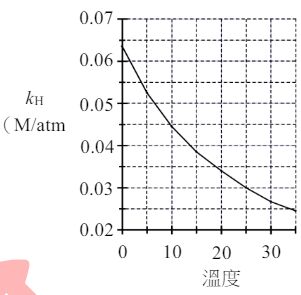
29. 碳酸飲料(如汽水)的製備是利用亨利定律的原理,將二氧化碳壓入裝有含糖調味料飲用水的玻璃瓶中後, 再加以密封。依據亨利定律,氣體在溶劑中的溶解度( S )與液面上該氣體的分壓( p )成正比,其比例 常數稱為亨利定律常數( kH ),關係式可表示如下:
S= kH✖p
式中的 S 與 p 的單位分別為體積莫耳濃度(M)與大氣壓力(atm),而 CO2 的 kH 與溫度的關係如右圖所示。
CO2 (g) 溶入水中生成 CO2 (aq) 後,小部分溶入水中的 CO2 (aq) 會與水反應形成 H2CO3(aq) ,在 25℃時,其平衡反應式與平衡常數如下: 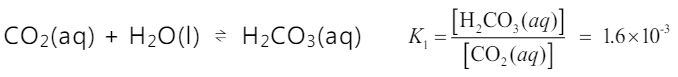 而 H2CO3 (aq) 在水中會解離成 H+(aq) 與 HCO3-(aq),其平衡反應式與平衡常數如下:
而 H2CO3 (aq) 在水中會解離成 H+(aq) 與 HCO3-(aq),其平衡反應式與平衡常數如下:
H2CO3(aq) ⇌ H + (aq) + HCO3- (aq) Ka=2.5✖10-4
今有一未開罐的汽水瓶,於 25℃時,瓶內上方的 CO2 (g) 壓力為 2.5 大氣壓,若其性質遵守亨利定律,求 出下列數值。