題組內容
25-27題為題組
現代的社會強調「資源可持續回復,循環再生」的循環經濟。鉛蓄電池因使用量
非常龐大,環保署公告2020年回收的廢鉛蓄電池總處理量高達6萬多公噸。而
廢鉛蓄電池中主要含金屬鉛(Pb)、氧化鉛(PbO)、二氧化鉛(PbO2)、硫酸鉛
(PbSO4)。某研究團隊設計以下流程,可從廢鉛蓄電池中提煉高純度的PbO。
I.將含有廢鉛蓄電池的廢料、濃度2.0M的H2SO4、0.1M的FeSO4(在溶液中解 離成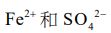 )溶液的混合物在65℃進行反應,所產生的PbSO4可以式(2)
表示:
Pb(s)+PbO2(s)+2H2SO4(aq)→2PbSO4(s)+2H2O(l) 式(2)
)溶液的混合物在65℃進行反應,所產生的PbSO4可以式(2)
表示:
Pb(s)+PbO2(s)+2H2SO4(aq)→2PbSO4(s)+2H2O(l) 式(2)
I.將含有廢鉛蓄電池的廢料、濃度2.0M的H2SO4、0.1M的FeSO4(在溶液中解 離成
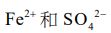 )溶液的混合物在65℃進行反應,所產生的PbSO4可以式(2)
表示:
Pb(s)+PbO2(s)+2H2SO4(aq)→2PbSO4(s)+2H2O(l) 式(2)
)溶液的混合物在65℃進行反應,所產生的PbSO4可以式(2)
表示:
Pb(s)+PbO2(s)+2H2SO4(aq)→2PbSO4(s)+2H2O(l) 式(2) II.將實驗I 的 PbSO4 粗產物溶於 10% NaOH 溶液,加熱,並趁熱過濾;待濾液
冷卻至室溫後,過濾並收集含 PbO 的粗產物。
III. 將實驗 II 的 PbO 粗產物置於 35% NaOH 溶液中,在 110℃下攪拌至完全溶解
後趁熱過濾,靜置濾液使其冷卻至室溫,可得高純度的黃色物質即為 PbO。
該研究團隊為探究 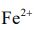 在實驗 I 中 扮 演 的 角 色,利 用 鐵 離 子 會 與 SCN 產生錯合物
的特性,又進行以下兩個實驗:
在實驗 I 中 扮 演 的 角 色,利 用 鐵 離 子 會 與 SCN 產生錯合物
的特性,又進行以下兩個實驗:
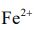 在實驗 I 中 扮 演 的 角 色,利 用 鐵 離 子 會 與 SCN 產生錯合物
的特性,又進行以下兩個實驗:
在實驗 I 中 扮 演 的 角 色,利 用 鐵 離 子 會 與 SCN 產生錯合物
的特性,又進行以下兩個實驗: IV. 65℃時,於 2.0 M 的 H 2 SO4 與 0.1 M 的 FeSO4的水溶液中加入適量 KSCN 水 溶
液後,溶液幾乎無色;但是若加入少量 PbO2後,溶液呈紅色,並有白色 PbSO4
固體產生。
V. 取出實驗 IV 的紅色溶液置於另一試管;在 65℃時,加入鉛粉,溶液又變成 幾乎無色,且有白色 PbSO4 固體產生。 回答下列問題:
V. 取出實驗 IV 的紅色溶液置於另一試管;在 65℃時,加入鉛粉,溶液又變成 幾乎無色,且有白色 PbSO4 固體產生。 回答下列問題: